No se ha encontrado investigadores para este término.
Información general
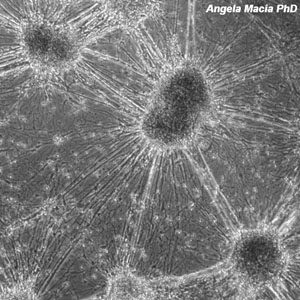
La microscopía óptica es una técnica que permite la observación de muestras en su mayoría traslúcidas, o en el caso de ser opacas, con una superficie de reflexión que no se encuentra perfectamente pulida. La luz incide sobre la muestra a distintas profundidades, generando una imagen borrosa debido a la detección de luz procedente de zonas fuera del plano de enfoque, lo que provoca una importante degradación en la nitidez, contraste y resolución de la imagen.
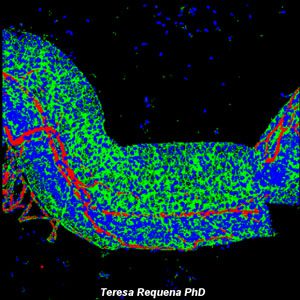
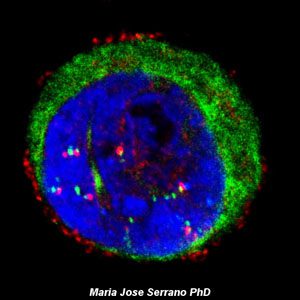
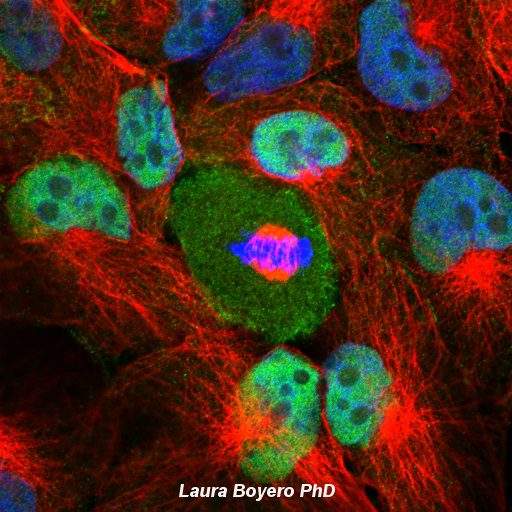
La microscopía láser confocal aparece con gran éxito tras el desarrollo del láser, logrando excelentes resultados en diversas disciplinas (medicina, biología, geología, etc.), debido a sus indudables ventajas frente a la microscopía óptica tradicional. El principio de la microscopía láser confocal se basa en la eliminación de la luz reflejada o fluorescencia procedente de los planos fuera de foco. Para ello, se ilumina la muestra punto por punto con una línea de láser y se detecta únicamente la luz que proviene del plano focal, eliminándose los haces de los planos inferiores y superiores, generando de esta manera imágenes de elevada nitidez, contraste y resolución. Además, con la microscopía láser confocal se pueden obtener secciones ópticas de la muestra, lo que permite su estudio tridimensional.
La microscopía de Fluorescencia de Reflexión Interna Total (TIRF) se basa en un tipo de iluminación que genera una onda o campo evanescente de un grosor aproximado de 100 nm, produciendo la excitación de una región limitada de la muestra, localizada adyacente a la interfase entre dos medios que presentan distintos índices de refracción. En la práctica, la interfase más comúnmente utilizada en TIRF, es el área de contacto entre la membrana plasmática basal de la célula y el vidrio o sustrato sobre el que se adhiere la célula. La microscopía TIRF permite llevar a cabo un amplio rango de aplicaciones en biología celular, como analizar la localización y distribución dinámica de moléculas fluorescentes cerca de la membrana plasmática basal de las células.
La técnica de microdisección por captura láser se centra en la observación y separación de células únicas o pequeños grupos celulares de un tejido heterogéneo de manera selectiva, eficiente y rápida, lo que posibilita el estudio sistemático de la calidad y cantidad de biomoléculas (DNA, RNA o proteínas) en poblaciones celulares específicas. Esta tecnología, que originalmente fue desarrollada para el análisis molecular de tumores, hoy puede ser aplicada a una gran variedad de tejidos, y facilita el estudio de las bases moleculares de numerosas enfermedades, como aquellas asociadas a la variabilidad genética humana, tales como cáncer, enfermedades raras, enfermedades degenerativas, diabetes e hipertensión, entre otras.
La Unidad de Microscopía e Imagen Molecular en GENyO se dedica a la aplicación y el desarrollo de diferentes técnicas avanzadas de microscopía láser confocal, como el análisis de la localización y distribución dinámica de moléculas de interés en células o modelos animales, abriendo un abanico muy amplio de nuevas posibilidades a la hora de abordar estudios dinámicos de procesos celulares. También cuenta con equipamiento específico para realizar la técnica de microscopía de Fluorescencia de Reflexión Interna Total (TIRF), con el fin de visualizar procesos de movilidad celular, agregación y adhesión de proteínas, endocitosis, exocitosis y transporte de vesículas entre otros, procesos localizados en la región de la membrana plasmática basal de las células. Asimismo, en la unidad se lleva a cabo la técnica de microdisección por captura láser, que permite el aislamiento de poblaciones celulares puras o células individuales para su posterior estudio genómico o proteómico.
Personal
Cartera de servicios
Equipamiento
La Unidad dispone de los siguientes equipos de microscopía de epifluorescencia, microscopía láser confocal, microscopía TIRF y microdisección por captura láser, cuyas principales características son:
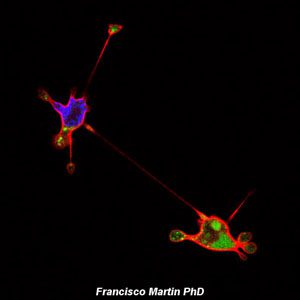
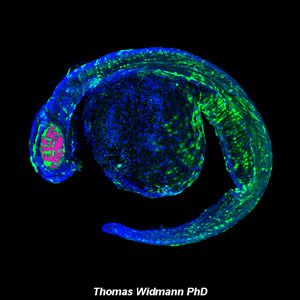
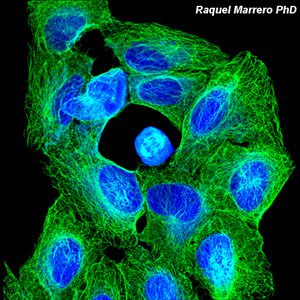
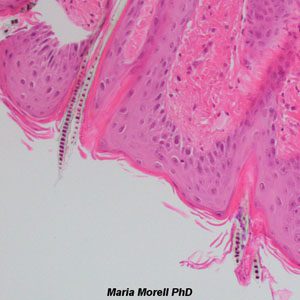
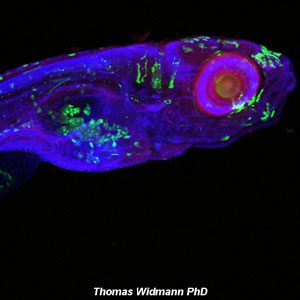
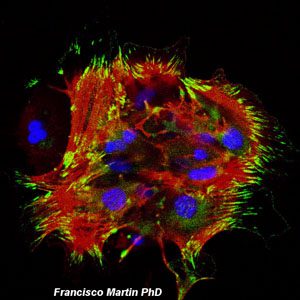
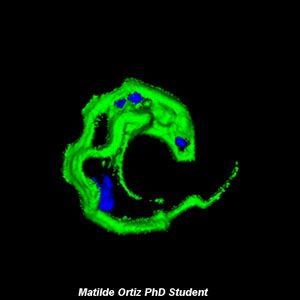
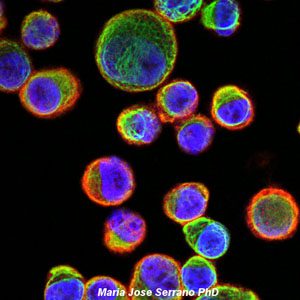
Galería